Parcours
2016: Directrice de Recherches (DR2) au CNRS
2009: Habilitation à diriger les Recherches (HDR)
2002: Chargée de Recherches au CNRS (CR)
2000-2001 : Stage post-doctoral en Spectroscopie Raman avec le Pof. Peter Hildebrandt au Max Planck Institut für Strahlenchemie, Mülheim / Ruhr (Allemagne) et à Instituto de Tecnológia Química e Biológica, Oeiras (Portugal).
1997-2000 : Thèse en Chimie Bio-inorganique, ICMMO, Université Paris-Sud (Orsay), dirigée par les Prof Jean-Jacques GIRERD et Frédéric Banse
1996 : Obtention de l' «Agrégation externe de Sciences Physiques Option Chimie »
1993 -1997: Scolarité à « Ecole Normale Supérieure de Cachan » section Chimie. « Magistère de Physicochimie Moléculaire » Université Paris-XI, Orsay.
Distinctions
- Elève normalienne (1993-1997)
- Bourse Allocataire Moniteur Normalien (1997-2000)
- Bourse d'installation de la ville de Marseille (2002)
- Professeure invitée à l'Université de Cuernavaca (UNAM), Mexique (2010)
- Ambassadrice de la ville de Marseille et trophée de l'attractivité (2017)
- Prix de l'Innovation Biomimétique Région PACA (2019)
Thématiques
Monooxygenases à cuivre et modèles bio-inspirés
- En collaboration avec: Marius Réglier, Bruno Faure, Alexandre Ciaccafava, Maylis Orio
- Etudiants en cours: Iris Wehrung (co-direction avec M. Orio; 2023-); Miroslava Arronte Morales (co-tutelle avec I. Castillo à Mexico)
- Postdocs en cours: Khalil Youssef & Subhankar Sutradhar
Anciens étudiants: Yongxing Wang (co-direction A. Martinez & M. Orio, 2021-2024); Rébecca Leblay (co-direction B. faure; 2021-2024); Manon Pujol (co-direction C. Decroos; 2019-2023); Stefani Gamboa (co-direction M. Orio; 2019-2023); Rogelio Gomez Pineiro (co-direction M. Orio; 2018-2021); Alessia Munzone (co-direction C. Decroos; 2017-2021), Marianthi Kafentzi (co-direction M. Réglier; 2013-2016)
Etudes structure-fonction des Lytic Polysaccharides Monooxygenases (LPMO)
La conversion de la biomasse en produits chimiques biosourcés est une stratégie importante pour l'avenir. En particulier, l'utilisation de parties non comestibles de plantes provenant de résidus agricoles ou forestiers (biomasse lignocellulosique) pour la production de biocarburants ou de produits chimiques est hautement souhaitable pour éviter la concurrence avec les réserves de nourriture ou d'eau. Cependant, la valorisation de la lignocellulose (principalement composée de cellulose, d'hémicellulose et de lignine) reste un défi et sa résistance naturelle à la déconstruction est en grande partie responsable des coûts élevés.
Les Lytic Polysaccharide Monooxygenases ou LPMOs sont des enzymes fongiques ou bactériennes, qui accélèrent la dégradation des polysaccharides récalcitrants grâce à des mécanismes oxydatifs. Les LPMOs réalisent l'hydroxylation de liaisons C-H proximité de la liaison glycosidique en présence de dioxygene ou d'eau oxygénée, menant à une rupture de chaine du polymère (Fig. 1A). La LPMO possède un ion du cuivre exposé à la surface et coordonné par deux histidines dont l'histidine N-terminale liée de façon bidente par la fonction imidazole et l'amine primaire terminale (Fig. 1B). Ce motif de coordination inhabituel est appelé Histidine-brace. De nombreuses questions demeurent sur le mode d'action de ces systèmes enzymatiques.
Au laboratoire, nous étudions des LPMOs bactériennes actives sur chitine de la famille AA10 (https://www.cazy.org). Nos études sont centrées sur la compréhension des mécanismes et sur l'influence de différents paramètres (pH par example) des cofacteurs, des résidus du site actif, de l'interaction avec le substrat sur les propriétés de l'enzyme. Nous menons des études pluridisciplinaires (spectroscopiques, redox, fonctionnelles, etc) pour mieux comprendre ce système enzymatique.

Collaborations externes: Prof. Serena DeBeer (MPI, Mülheim-Ruhr, Allemagne); Dr. Guido Pintacuda (CRMN, CNRS, Lyon); Dr. Senta Heiss-Blanquet et Dr. Simon Arragain (IFPEN), Dr. Sylvain Bertaina (IM2NP, CNRS, Marseille); Dr. Christelle Hureau (LCC, CNRS, Toulouse).
Complexes de cuivre modèles bioinspirés des LPMO.
Nous développons des complexes de cuivre bioinspirés par le site actif des enzymes comme la LPMO pour réaliser l'activation de petites molécules (e.g. O2, H2O) dans le but à la fois de de comprendre les mécanismes mis en jeu, isoler et caractériser des espèces réactives, mais également de proposer des systèmes fonctionnels et catalytiques dans des conditions douces.

En particulier, nous sommes impliqués le développement de catalyseurs bioinspirés de la LPMO pour la dégradation de la biomasse (prix de l'innovation Biomimétique Région PACA 2019). Nous préparons des complexes de cuivre et des métallopeptides à cuivre mimant les principales caractéristiques structurales et fonctionnelles des LPMOs. Nous avons mis au point des tests de criblage de leurs activités en milieu aqueux sur des substrats solubles et récemment obtenu une preuve de concept que certains des complexes pouvaient réaliser des coupures oxydantes sur des substrats complexes (Fig. 2; Leblay et al. ChemCatChem, 2023, 15(23), e202300933).
Collaborations externes: Dr. Catherine Belle, Dr. Hélène Jamet and Dr. Aurore Thibon-Pourret (Université Grenoble-Alpes / CNRS); Dr. Nicolas Le Poul (Université de Bretagne Occidentale, CNRS); Prof. Ivan Castillo (UNAM, Mexico, ECOS-Nord project); Dr. Christelle Hureau (LCC, Toulouse), Dr. Jean-Guy Berrin (BBF, INRAE Marseille), Dr. Laurent Heux & Yoshi Nishiyama (CERMAV, Grenoble)
Etude d'une enzyme à fer non hémique: l'ACC Oxydase
En collaboration avec: Thierry Tron, Marius Réglier (iSm2, BiosCiences)
Etudiants (anciens): Dr. Eugénie Fournier (co-direction V. Belle; 2015-2018)
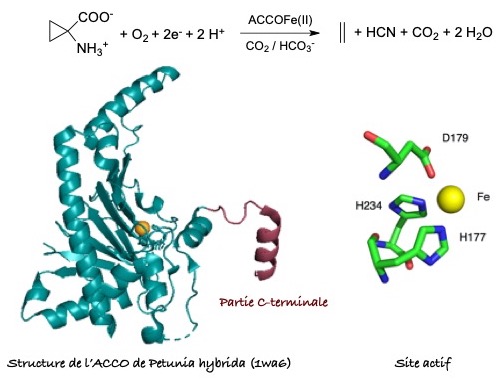
L'éthylène, simple oléfine, est une hormone impliquée dans de nombreux processus de développement et de défense chez les plantes. L'ACC Oxydase catalyse la dernière étape de biosynthèse de l'éthylène chez les plantes. L'ACC Oxydase convertit l'acide 1-aminocyclopropane carboxylique (ACC) en éthylène en présence de dioxygène et d'électrons (ascorbate). Les produits sont l'éthylène et le cyanoformate (qui se décompose en HCN + CO2). Par ailleurs, pour des raisons encore mal comprises, l'ACC Oxydase nécessite la présence de CO2 (ou HCO3-) pour fonctionner. Les structures cristallographiques révèlent un coeur replié en tonneau béta qui contient le site actif. Le site actif contient un ion Fe(II) dans un environnement non hémique lié à 2 histidines et 1 aspartate dans une triade faciale. Malgré la résolution de plusieurs structures cristallographiques, des questions demeurent sur la conformation de l'enzyme active et notamment sur la conformation et la dynamique de la partie C-terminale (en rouge sur la figure ci-contre).
Les études menées au laboratoires sont centrées sur:
- la compréhension du mécanisme de l'enzyme
- l'étude de la conformation et de la dynamique de la partie C-terminale
- la préparation de complexes modèles
- Le développement d'enzymes artificielles basées sur l'ACCO
Collaborations externes: Prof. Valérie Belle et Dr. Marlène Martinho (Université d'Aix-Marseille); Prof. Christian Limberg (Humboldt University, Berlin, Germany); Dr. Wadih Ghattas (Université Paris-Saclay), Prof. Sam de Visser (Univ. Manchester, UK).
Projets financés (<10 ans)
- Projet AMIDEX DYNACCO (coordinatrice); 2015-2018; 434 k€ (@iSm2 = 180 k€)
- Projet ANR PRCI (ANR-DFG) CUBISM (coordinatrice, ANR-18-CE92-0040); 2019-2023; (@iSm2 = 153 k€)
- Projet ANR COSACH (partenaire, ANR-22-CE07-0032); on-going; 458 k€ (@iSm2 = 149 k€)
- projet ANR INSPIRE (coordinatrice, ANR-23-CE43-0012); on-going; 496 k€ (@iSm2 = 175 k€)
- projet ANR LPMO-PEPS (partenaire, ANR-24-CE07-6490); on-going; 398 k€ (@iSm2 = 198 k€)
- Projet France 2030 PEPR BBEST PuLCO (coordinatrice, ANR-24-PEBB-0009); on-going; 1.4 M€ (@iSm2 = 280 k€)
Responsabilités administratives
- Présidente du bureau de la Division de Chimie de Coordination (DCC) de la Société Chimique de France (SCF) (https://new.societechimiquedefrance.fr/divisions/chimie-de-coordination/...)
Articles de vulgarisation
Diels-Alderases artificielles au service de la chimie verte. Wadih Ghattas, Jean-Pierre Mahy, Rémy Ricoux, A. Jalila Simaan, Marius Réglier
Techniques de l’Ingénieur, date publication le 10 septembre 2021, ref : IN404 V1

